Konsentrasi Larutan
Konsetrasi LarutanKonsetrasi larutan merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut.
- Konsentrasi : jumlah zat tiap satuan volum (besaran intensif)
- Larutan encer : jumlah zat terlarut sangat sedikit
- Larutan pekat : jumlah zat terlarut sangat banyak
- Cara menyatakan konsentrasi: molar, molal, persen, fraksi mol, bagian per sejuta (ppm), dll
Molaritas (M)
Molaritas adalah jumlah mol zat terlarut dalam satu liter larutan. Rumus Molaritas adalah :

Contoh :
Berapakah molaritas 0.4 gram NaOH (Mr = 40) dalam 250 mL larutan ?
Jawab :

Normalitas (N)
Normalitas merupakan jumlah mol-ekivalen zat terlarut per liter larutan. Terdapat hubungan antara Normalitas dengan Molaritas, yaitu :
![]()
Mol-ekivalen :
- Asam/basa: jumlah mol proton/OH- yang diperlukan untuk menetralisir suatu asam / basa.
Contoh :
1 mol Ca(OH)2 akan dinetralisir oleh 2 mol proton;
1 mol Ca(OH)2 setara dengan 1 mol-ekivalen; Ca(OH)2 1M = Ca(OH)2 2N
- Redoks : jumlah mol elektron yang dibutuhkan untuk mengoksidasi atau mereduksi suatu unsur
Contoh :
1 mol Fe+3 membutuhkan 3 mol elektron untuk menjadi Fe;
1 mol Fe+3 setara dengan 3 mol-ekivalen;
Fe+3 1 M = Fe+3 3 N atau Fe2O3 6 N
Molalitas (m)
Molalitas adalah jumlah mol zat terlarut dalam 1000 gram pelarut.
Rumus Molalitas adalah :

Contoh :
Berapa molalitas 4 gram NaOH (Mr=40) dalam 500 gram air?
Jawab :
molalitas NaOH
= (4/40)/500 g air
= (0.1 x 2 mol)/1000 g air
= 0,2 m
Fraksi Mol (X)
Fraksi mol adalah perbandingan antara jumlah mol suatu komponen dengan jumlah total seluruh komponen dalam satu larutan. Fraksi mol total selalu satu. Konsentrasi dalam bentuk ini tidak mempunyai satuan karena merupakan perbandingan.
Contoh :
Suatu larutan terdiri dari 2 mol zat A, 3 mol zat B, dan 5 mol zat C. Hitung fraksi mol masing-masing zat !
Jawab :
XA = 2 / (2+3+5) = 0.2
XB = 3 / (2+3+5) = 0.3
XC = 5 / (2+3+5) = 0.5
XA + XB + XC = 1
Kenaikan Titik Didih
Apabila kita merebus air dalam panci tertutup, maka air tersebut akan mendidih saat tekanan uap dalam panci mencapai 1 atm, oleh sebab itulah merebus air dalam keadaan tertutup lebih cepat mendidih dibandingkan dengan keadaan terbuka.itu yang difebut dengan titik didih.
apabila kita tambahkan garam didalamnya
Titik didih larutan lebih tinggi dibandingkan dengan titik didih pelarut murninya. Jadi apabila kita membandingkan titik didih air murni dengan larutan garam maka titik didih larutan garam akan lebih tinggi dibandingkan dengan titik didih air murni.Dari penjelasan hokum Raoult dan tekanan uap larutan kita tahu bahwa adanya zat terlarut yang tidak mudah menguap di dalam suatu pelarut akan menurunkan tekanan uap pelarutnya, akibatnya tekanan uap larutan akan lebih kecil dibandingkan dengan tekanan uap pelarut murninya. Dengan demikian semakin banyak energi yang diperlukan untuk mencapai tekanan uap sebesar 1 atm, sehingga larutan akan memiliki titik didih yang lebih tinggi.Jadi bila di buat kesimpulan adalah sebagai berikut:
Pelarut + zat terlarut non-volatil -> larutan -> tekanan uapnya rendah -> titik didih menjadi lebih tinggi dibandingkan pelarut murni
Dari sini muncul istilah kenaikan titik didih larutan yang dirumuskan sebagai
Dimana ?T adalah kenaikan titik didih, Kb adalah konstanta kenaikan titik didih, m adalah molalitas zat terlarut. Molalitas (m) larutan dicarai dengan menggunakan rumus;
Untuk penurunan titik beku persamaannya dinyatakan sebagai :
DTf = m . Kf = W/Mr . 1000/p . Kf
dimana:
DTf = penurunan titik beku
m = molalitas larutan
Kf = tetapan penurunan titik beku molal
W = massa zat terlarut
Mr = massa molekul relatif zat terlarut
p = massa pelarut
Apabila pelarutnya air dan tekanan udara 1 atm, maka titik beku larutannya dinyatakan sebagai:
Tf = (O - DTf)oC
Tekanan osmotik adalah tekanan yang diberikan pada larutan yang dapat menghentikan perpindahan molekul-molekul pelarut ke dalam larutan melalui membran semi permeabel (proses osmosis).
Menurut VAN'T HOFF tekanan osmotik mengikuti hukum gas ideal:
PV = nRT
Karena tekanan osmotik = p , maka :
p = n/V R T = C R T
dimana :
p = tekanan osmotik (atmosfir)
C = konsentrasi larutan (mol/liter= M)
R = tetapan gas universal = 0.082 liter.atm/moloK
T = suhu mutlak (oK)
- Larutan yang mempunyai tekanan osmotik lebih rendah dari yang lain
disebut larutan Hipotonis.
- Larutan yang mempunyai tekanan osmotik lebih tinggi dari yang lain
disebut larutan Hipertonis.
- Larutan-larutan yang mempunyai tekanan osmotik sama disebut
Isotonis.

Sifat Koligatif Larutan elektrolit
Sif at koligatif larutan adalah sifat larutan yang tidak tergantung pada macamnya zat terlarut tetapi semata-mata hanya ditentukan oleh banyaknya zat terlarut (konsentrasi zat terlarut).
at koligatif larutan adalah sifat larutan yang tidak tergantung pada macamnya zat terlarut tetapi semata-mata hanya ditentukan oleh banyaknya zat terlarut (konsentrasi zat terlarut).
Sifat koligatif meliputi:
1. Penurunan tekanan uap jenuh
2. Kenaikan titik didih
3. Penurunan titik beku
4. Tekanan osmotik
Banyaknya partikel dalam larutan ditentukan oleh konsentrasi larutan dan sifat Larutan itu sendiri. Jumlah partikel dalam larutan non elektrolit tidak sama dengan jumlah partikel dalam larutan elektrolit, walaupun konsentrasi keduanya sama. Hal ini dikarenakan larutan elektrolit terurai menjadi ion-ionnya, sedangkan larutan non elektrolit tidak terurai menjadi ion-ion. Dengan demikian sifat koligatif larutan dibedakan atas sifat koligatif larutan non elektrolit dan sifat koligatif larutan elektrolit.
larutan elektrolit di dalam pelarutnya mempunyai kemampuan untuk mengion. Hal ini mengakibatkan larutan elektrolit mempunyai jumlah partikel yang lebih banyak daripada larutan non elektrolit pada konsentrasi yang sama
Contoh:
Larutan 0.5 molal glukosa dibandingkan dengan iarutan 0.5 molal garam dapur.
- Untuk larutan glukosa dalam air jumlah partikel (konsentrasinya) tetap, yaitu 0.5 molal.
- Untuk larutan garam dapur: NaCl(aq) --> Na+ (aq) + Cl- (aq) karena terurai menjadi 2 ion, maka konsentrasi partikelnya menjadi 2 kali semula = 1.0 molal.
Yang menjadi ukuran langsung dari keadaan (kemampuannya) untuk mengion adalah derajat ionisasi.
Besarnya derajat ionisasi ini dinyatakan sebagai:
a = jumlah mol zat yang terionisasi/jumlah mol zat mula-mula
Untuk larutan elektrolit kuat, harga derajat ionisasinya mendekati 1, sedangkan untuk elektrolit lemah, harganya berada di antara 0 dan 1 (0 < a <>
Atas dasar kemampuan ini, maka larutan elektrolit mempunyai pengembangan di dalam perumusan sifat koligatifnya.
1. Untuk Kenaikan Titik Didih dinyatakan sebagai:
DTb = m . Kb [1 + a(n-1)] = W/Mr . 1000/p . Kb [1+ a(n-1)]
n menyatakan jumlah ion dari larutan elektrolitnya.
2. Untuk Penurunan Titik Beku dinyatakan sebagai:
DTf = m . Kf [1 + a(n-1)] = W/Mr . 1000/p . Kf [1+ a(n-1)]
3. Untuk Tekanan Osmotik dinyatakan sebagai:
p = C R T [1+ a(n-1)]
Contoh:
Hitunglah kenaikan titik didih dan penurunan titik beku dari larutan 5.85 gram garam dapur (Mr = 58.5) dalam 250 gram air ! (bagi air, Kb= 0.52 dan Kf= 1.86)
Jawab:
Larutan garam dapur, NaCl(aq) --> NaF+ (aq) + Cl- (aq)
Jumlah ion = n = 2.
DTb = 5.85/58.5 x 1000/250 x 0.52 [1+1(2-1)] = 0.208 x 2 = 0.416oC
DTf = 5.85/58.5 x 1000/250 x 0.86 [1+1(2-1)] = 0.744 x 2 = 1.488oC
Catatan:
Jika di dalam soal tidak diberi keterangan mengenai harga derajat ionisasi, tetapi kita mengetahui bahwa larutannya tergolong elektrolit kuat, maka harga derajat ionisasinya dianggap 1.

 reaksi redoks dan sel elektrokimia
reaksi redoks dan sel elektrokimiaRedoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:
Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah: reaksi oksidasi
dan reaksi reduksi
Penganalisaan masing-masing reaksi setengah akan menjadikan keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Dan ion-ion akan bergabung membentuk hidrogen fluorida:
Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi. Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian atom dalam senyawa.
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Persamaan ion dari reaksi ini adalah:
Terlihat bahwa besi teroksidasi:
dan tembaga tereduksi:
Media asam
Pada media asam, ion H+ dan air ditambahkan pada reaksi setengah untuk menyeimbangkan keseluruhan reaksi. Sebagai contoh, ketika mangan(II) bereaksi dengan natrium bismutat:
Reaksi ini diseimbangkan dengan mengatur reaksi sedemikian rupa sehingga dua setengah reaksi tersebut melibatkan jumlah elektron yang sama (yakni mengalikan reaksi oksidasi dengan jumlah elektron pada langkah reduksi, demikian juga sebaliknya).
Reaksi diseimbangkan:
Hal yang sama juga berlaku untuk sel bahan bakar propana di bawah kondisi asam:
Dengan menyeimbangkan jumlah elektron yang terlibat:
Persamaan diseimbangkan:
Media basa
Pada media basa, ion OH- dan air ditambahkan ke reaksi setengah untuk menyeimbangkan keseluruhan reaksi.Sebagai contoh, reaksi antara kalium permanganat dan natrium sulfit:
Dengan menyeimbangkan jumlah elektron pada kedua reaksi setengah di atas:
Persamaan diseimbangkan:
SEL ELEKTROKIMIA
| 1. | Sel Volta/Galvani 1. terjadi penubahan : energi kimia ® energi listrik
|
| 2. | Sel Elektrolisis 1. terjadi perubahan : energi listrik ® energi kimia |
Sel elektrolisis adalah sel elektrokimia yang menimbulkan terjadinya reaksi redoks yang tidak spontan dengan adanya energi listrik dari luar. Contohnya adalah elektrolisis lelehan NaCl dengan electrode platina. Contoh lainnya adalah pada sel Daniell jika diterapkan beda potensial listrik dari luar yangarnya melebihi potensial sel Daniell.
smber :http://kambing.ui.ac.id/>kimia
http://belajarkimia.com
http://www.chem-is-try.org/materi_kimia/kimia-smk
http://id.wikipedia.org/wiki/Redokshttp://kimia.upi.edu/utama/bahanajar/kimia%20dasar/elektrokimia/Sel%20elektrolisis.htm





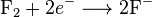

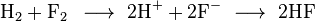






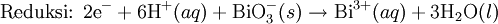

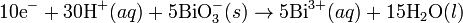
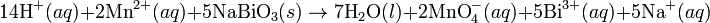

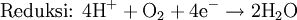
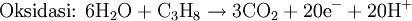






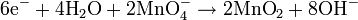


Tidak ada komentar:
Posting Komentar